Đề ôn thi học kì 1 Hóa lớp 10 đề số 3
Nội dung tài liệu
Tải xuốngCác tài liệu liên quan
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 7]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 2]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 4]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 3]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 6]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 2]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 4]()
Có thể bạn quan tâm
Thông tin tài liệu
ĐỀ ÔN TẬP HỌC KÌ 1 (ĐỀ SỐ 3)
I. Phần trắc nghiệm:
Câu 1: Cho các phương trình phản ứng sau :
a) SO2 + Cl2 + 2H2O → H2SO4 +2 HCl b) 2NO2+ 2NaOH → NaNO2 + NaNO3 + H2O
c) CO2 + NaOH → NaHCO3 d) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
e) 3Fe3O4 +28HNO3 → 9Fe(NO3)3+NO + 14H2O f) Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
g) AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag h) C2H6 + Cl2 → C2H5Cl + HCl
i)CH3CH2OH + CuO → CH3CHO + Cu + H2O k) Fe + 2Fe(NO3)3 → 3Fe(NO3)2 .
Số phản ứng oxi hoá khử là :
A.6 B. 7 C.8 D.9
Câu 2: Trong phản ứng : Cl2 + 2KOH  KCl + KClO + H2O
KCl + KClO + H2O
A. Cl2 Vừa là chất oxi hoá, vừa là chất khử. B. Cl2 Không là chất oxi hoá, không là chất khử.
C. Cl2 Chỉ là chất oxi hoá . D. Cl2 Chỉ là chất khử
Câu 3: Hãy chọn phản ứng mà SO2 có tính oxi hoá :
A. 5SO2 + 2KMnO4 +
2H2O  K2SO4 + 2MnSO4 +
2H2SO4 B. SO2 +
Na2O
K2SO4 + 2MnSO4 +
2H2SO4 B. SO2 +
Na2O  Na2SO3
Na2SO3
C. SO2 + 2H2O + Br2
 2HBr + H2SO4 D. SO2 +
2H2S
2HBr + H2SO4 D. SO2 +
2H2S  3S + 2H2O
3S + 2H2O
Câu 4: Cho phản ứng hoá học: Fe + CuSO4 FeSO4 + Cu. Trong phản ứng này đã xảy ra:
A. Sự oxi hoá Fe và sự oxi hoá Cu. B. Sự khử Fe2+ và sự oxi hoá Cu.
C. Sự khử Fe2+ và sự khử Cu2+ D. Sự oxi hoá Fe và sự khử Cu2+
Câu 5: Cho các phương trình hoá học :
a) SO2 + 2H2O + Br2 → 2HBr + H2SO4 b) SO2 + H2O ⇄ H2SO3
c) 5SO2 + 2KMnO4 + 2H2O → K2SO4 +2MnSO4+2H2SO4 d) SO2 + 2H2S → 3S + 2H2O
e) 2SO2 + O2 ⇄ 2SO3 .
SO2 đều là chất khử trong các phản ứng hoá học:
A. a , b, c, d , e B.a , d , e C.a , d , c , e D.a , c , e
Câu 6 . Cho phản ứng cháy CuFeS2 tạo ra sản phẩm là CuO, Fe2O3 và SO2 thì một phân tử CuFeS2 sẽ:
A. nhận 12 electron. B. Nhận 13 electron.
C. nhường 12 electron. D. nhường 13 electron.
Câu 7: Hòa tan hoàn toàn m gam Fe vào dung dịch HNO3 loãng, dư thu được 0,448 lít khí NO duy nhất (đktc). Giá trị m là
A. 1,12 B. 5,6 C. 0,56 D. 11,2
Câu 8: Cho 40g hỗn hợp ZnO, FeO, Fe2O3, Fe3O4, MgO tác dụng hết với 200ml dung dịch HCl 0,5M (vừa đủ) thu được dung dịch X. Khối lượng muối có trong X là
A. 43,65 g. B. 50,90 g. C. 42,75 g. D. Kết quả khác.
Câu 9: Cho 4,875 g một kim loại M hóa trị II tác dụng hết với dung dịch HNO3 loãng thu được 1,12 lit khí NO duy nhất (đktc). Kim loại M là:
A. Mg B. Zn C. Ni D. Cu
Câu 10. Cho 2,52 g một kim loại tác dụng hết với dung dịch H2SO4 loãng thu được 6,84 g muối sunfat. Kim loại đó là:
A. Mg B. Zn C. Fe D. Al
Câu 11. Phân tử nào sau đây mà số cặp electron chưa tham gia liên kết là 4:
A. HCl B. N2 C. CO2 D. H2O.
Câu 12. Đồng có 2 đồng vị bền 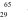 và
và  .
Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm
số nguyên tử của đồng vị đồng có số khối 63.
.
Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm
số nguyên tử của đồng vị đồng có số khối 63.
A. 27% B. 73% C. 26,5% D. 73.5%
Câu 13. Nguyên tử nguyên tố X có số thứ tự là 19 trong bảng tuần hoàn, công thức phân tử của X với oxi và hiđro lần lượt là:
A. XO và XH2. B. XO và XH. C. X2O và XH. D. X2O và XH2.
Câu 14. Nguyên tố Y là phi kim thuộc chu kì 3 của bảng tuần hoàn, Y tạo được hợp chất khí với hiđro và công thức oxit cao nhất là YO3.
Nguyên tố Y tạo với kim loại M cho hợp chất có công thức MY2, trong đó M chiếm 46,67% về khối lượng. M là:
A. Mg (24) B. Fe (56) C. Cu (64) D. Zn (65).
Câu 15. Cho các nguyên tố X(Z=12), Y(Z=11), M(Z=14), N (Z=13). Tính kim loại được sắp xếp theo thứ tự giảm dần là:
A. Y > X > M > N. B. M > N > Y > X. C. M > N > X > Y. D. Y > X > N > M.
Câu 16. Tổng số hạt (p, n, e) của nguyên tử một nguyên tố thuộc nhóm VIIA là 28. Nguyên tử khối của nguyên tử này là:
A. 19. B. 21. C. 18. D. 20.
Câu 17. Nguyên tử nguyên tố R có tổng số các loại hạt là 180. Số hạt mang điện nhiều hơn số hạt không mang điện là 32. Số nơtron của R là :
A. 53. B. 75. C. 74. D. 70.
Câu 18. Tổng số electron trong nhóm ion nào PO43– ; SiO32– ; ClO4– ; SO42– đều chứa 50 electron ?
A. PO43– ; SiO32– ; SO42–. B. PO43– ; SiO32– ; ClO4–.
C. SiO32– ; ClO4– ; SO42–. D. PO43– ; ClO4– ; SO42–.
Câu 19. Dãy chất nào dưới đây được xếp theo chiều tăng dần sự phân cực liên kết trong phân tử?
A. KCl, HCl, Cl2. B. Cl2, KCl , HCl.
C. HCl, Cl2, KCl. D. Cl2, HCl, KCl.
Câu 20. Kim loại A có khối lượng 2.352 gam tác dụng với Oxi tạo ra oxit có khối lượng 3.248 gam oxit. Kim loại A là:
A. Al B. Fe C. Cu D. Mg
II. Phần tự luận:
* Nguyên tử:
Câu 1. XO2- có tổng số hạt là 89. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 29. Xác định nguyên tố X. (Biết trong O có số hạt mang điện gấp đôi số hạt không mang điện).
Câu 2. Nguyên tử X của nguyên tố R có tổng số hạt cơ bản là 46. Số hạt không mang điện bằng 8/15 số hạt mang điện.
a) Xác định tên R.
b) Y là đồng vị của X. Y có ít hơn X là 1 nơtron và Y chiếm 4% về số ngtử của R. Tính nguyên tử lượng trung bình của R.
Câu 3. Nguyên tố Cl trong tự nhiên là một hh gồm hai đồng vị 35Cl và 37Cl .Nguyên tử khối trung bình của Clo là 35,5.Tính phần trăm về khối lượng của 35Cl trong muối kaliclorat KClO3 .
Câu 4. Tổng số hạt proton, nơtron và electron trong nguyên tử của nguyên tố Y là 28. Trong đó hạt không mang điện chiếm khoảng 35%. Hãy xác định cấu tạo hạt nhân ( số proton và nơtron), số khối A, viết cấu hình electron và gọi tên nguyên tố Y.
* Bảng tuần hoàn:
Câu 5. Để hòa tan hoàn toàn 1,16 g một hidroxit kim loại R hoá trị II cần dùng 1,46 g HCl. Xác định tên kim loại R, viết công thức hidroxit.
Câu 6. X là nguyên tố thuộc phân nhóm chính nhóm VII. Oxit cao nhất của nó có phân tử khối là 272 đvC.
a) Xác định tên X.
b) Y là kim loại hóa trị II. Cho 10,08 lít khí X (đkc) tác dụng Y thu được 90 g muối. Tìm tên Y.
Câu 7. Cho 3 g hỗn hợp X gồm một kim loại kiềm A và natri tác dụng với nước dư thu được dung dịch Y và khí Z. Để trung hoà dung dịch Y cần 0,2 mol HCl. Xác định nguyên tố A .
Câu 8. Oxit của R có dạng ROx có %O = a. Hợp chất khí với hidro của R có %H = b. Tỉ lệ giữa a và b bằng 10:2
Xác định R?
Câu 9. Một hợp chất của Cacbon là hidro có khối lượng riêng là 2.4107 gam/lít. %H trong hợp chất là 11,11%. Tìm công thức của hợp chất.
* Oxi hóa khử:
Câu 10. Cho một thanh đồng vào 50 ml dd AgNO3 .Sau một thời gian lấy thanh đồng ra sấy khô cân lại thấy nặng hơn trước 2,28 g.
a) Viết phương trình pư. Biểu diền các quá trình khử , oxi hóa.
b) Tính lượng Ag sinh ra và nồng độ Cu(NO3)2 trong dd nhận được.
Câu 11. Hòa tan m gam Zn bằng dd
HNO3 0,25M (vừa đủ) thu được 0,03 mol NO và 0,02 mol
NO2 và dd chứa x gam muối.
a) Viết phương trình pư và các quá trình khử , oxi hóa xảy ra.
b) Tính giá trị của m và x.
c) Tính thể tích dd HNO3 0,25M cần dùng.
Câu 12. Hỗn hợp gồm hơi S và Cl2 có thể tích là 2.912 lít ( đktc) có tỉ khối hơi so với hidro là 28. Cho hỗn hợp tác dụng với K và Mg thu được hỗn hợp muối có khối lượng là 13.64 gam. Tính % theo khối lượng của kim loại có trong hỗn hợp ban đầu.
Câu 13. Cho 0,48 gam Mg và 1.215 gam Al tác dụng với dung dịch HNO3 dư thu được hỗn hợp khí X gồm 336ml khí NO và 364 ml khí Y. (Là một trong các khí có thể cho sau đây: NO, N2O, NO2, N2). Xác định công thức của khí Y.











