Đề ôn thi học kì 1 Hóa lớp 10 đề số 15
Nội dung tài liệu
Tải xuốngCác tài liệu liên quan
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 7]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 2]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 4]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 3]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 6]()
-
![Đề thi học kì 2 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 2]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 1]()
-
![Đề thi giữa kì 1 Hóa 10 năm 2020-2021 ĐỀ 4]()
Có thể bạn quan tâm
Thông tin tài liệu
ĐỀ ÔN TẬP HỌC KÌ 1 (ĐỀ SỐ 15)
I. Trắc nghiệm: (6 điểm)
Câu 1: Trong nguyên tử một nguyên tố A có tổng số các loại hạt là 34. Biết số hạt p ít hơn số hạt n là 1 hạt. Số p, n, e trong nguyên tử A lần lượt là
A. 11, 12, 11. B. 12, 11, 11. C. 12, 11, 12. D. 11, 12, 12.
Câu 2: Trong các chất sau: NaCl, H2O, MgS, NH3, Al2O3. Các chất chỉ có liên kết ion là:
A. H2O, MgS. B. H2O, NH3. C. NaCl, Al2O3 D. NaCl, H2O.
Câu 3: Phát biểu không đúng là
A. Sự khử là sự mất electron. B. Chất khử là chất nhường electron.
C. Chất oxi hóa là chất thu electron. D. Sự oxi hóa là sự mất electron.
Câu 4: X là nguyên tử có chứa 20 proton, Y là nguyên tử có chứa 17 electron. Công thức hợp chất được hình thành giữa hai nguyên tử X và Y là
A. XY2 với liên kết ion. B. X2Y với liên kết cộng hóa trị.
C. XY với liên kết ion. D. X3Y2 với liên kết cộng hóa trị.
Câu 5: 1.( Z = 15). Chu kỳ 3, nhóm VA. 2. (Z = 17). Chu kỳ 3, nhóm VIIA
3.(Z = 23). Chu kỳ 4, nhóm VB. 4. (Z = 19). Chu kỳ 3, nhóm IB.
5.Z = 27). Chu kỳ 4, nhóm VIIB. 6. (Z = 35). Chu kỳ 4, nhóm VIIA.
Vị trí ứng đúng với Z là
A. (1, 2, 4, 6). B. (1, 3, 4, 6). C. (1, 2, 3, 6). D. ( 1, 2, 5, 6).
Câu 6: Đtích của các hạt electron và hạt nơtron trong các ngtử được quy ước lần lượt là:
A. -1, 0. B. 1- , 1+. C. 1+, 0. D. 1- , 0.
Câu 7: Cation X2+ có cấu hình e: 1s22s22p6, vị trí của X trong bảng tuần hoàn là:
A. Chu kỳ 3, nhóm IIA. B. Chu kỳ 2, nhóm VIA.
C. Chu kỳ 2, nhóm VIIIA. D. Chu kỳ 3, nhóm VIIIA.
Câu 8: Cho X (20 p, 20 n ) ; Y(18 p , 22 n ) ; Z ( 20 p , 22 n). Các đồng vị của cùng ngtố là:
A. Z , Y , X. B. Z , Y. C. X , Y D. X , Z.
Câu 9: Cho sơ đồ phản ứng: KMnO4 + KI + H2SO4 K2SO4 + MnSO4 + I2 + H2O. Hệ số cân bằng của các chất phản ứng lần lượt là:
A. 2, 8, 6. B. 3,7,5. C. 2, 10, 8. D. 4, 5, 8.
Câu 10: Phân lớp d chứa tối đa số electron là
A. 10 B. 6 C. 8 D. 2.
Câu 11: Thành phần % về khối lượng của nguyên tố kali trong hợp chất K2SO4 là
A. 22,41 %. B. 44,83%. C. 45,88%. D. 57,78%.
Câu 12: Nguyên tử của nguyên tố chứa đồng thời 20n, 19e, 19p là
A.  B.
B.  C.
C.  D.
D. 
Câu 13: Thứ tự tăng dần độ âm điện nào sau đây là đúng:
A. Na < Mg < Al < B < N < O. B. O < N < Mg < Na < Al < B.
C. Al < Mg< Na < B < O <N. D. Al < Na < Mg < B < N < O.
Câu 14: Số oxi hóa của sắt trong FeO, Fe2O3, Fe3O4, Fe lần lượt là
A. +2, +3, + 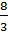
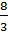 ; 0. B. +3, +2, +4, 0.
C. +2, +3, +4, 0. D. +3, +2, +
; 0. B. +3, +2, +4, 0.
C. +2, +3, +4, 0. D. +3, +2, + 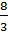
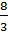 ; 0.
; 0.
Câu 15: Liên kết giữa Si và H là : ( biết χSi = 1,9 ; χH = 2,2)
A. liên kết cộng hóa trị không phân cực. B. liên kết cộng hóa trị có phân cực.
C. liên kết đơn. D. liên kết ion.
Câu 16: Cho 8,1g Al vào dung dịch H2SO4 đặc, nóng dư thu được V(l) SO2(đktc) (sản phẩm khử duy nhất). Giá trị của V là
A. 20,16. B. 6,72. C. 10,08. D. 3,36.
Câu 17: Cho 19,5g kim loại nhóm IA vào nước thu được 0,25 mol H2. Kim loại đó là
A. K. B. Na. C. Cs. D. Li.
Câu 18: Cặp chất chứa liên kết cộng hóa trị phân cực là
A. H2O và NaCl. B. N2 và Cl2. C. Cl2 và HCl. D. H2O và HCl.
Câu 19: Cho phản ứng sau: CuCl2 + 2AgNO3 → Cu(NO3)2 + 2AgCl thuộc kiểu phản ứng:
A. Trao đổi. B. Thế. C. Kết hợp. D. Phân hủy.
Câu 20: Phản ứng nào sau đây N trong HNO3 bị khử về số oxi hóa thấp nhất.
A. Cu + HNO3 → Cu(NO3)2 + NO2 + H2O.
B. Mg + HNO3 → Mg(NO3)2 + N2 + H2O.
C. Fe + HNO3 → Fe(NO3)3 + NO + H2O.
D. Al+HNO3 →Al(NO3)3+NH4NO3 + H2O
Câu 21: Hoà tan 8,3 gam hỗn hợp gồm Na và Ca trong 500ml dd HC l,4M thu được dd A và 4,48 lít khí H2 ở điều kiện tiêu chuẩn. Phần trăm số mol kim loại Ca trong hỗn hợp là :
A. 60% B. 50% C. 40% D. 30%
Câu22: Hỗn hợp X gồm hai kim loại A, B ở 2 chu kỳ liên tiếp ở phân nhóm chính nhóm II. Lấy 0,88g X cho tan hoàn toàn trong dd HCl dư thấy tạo ra 672 ml H2 (đktc). Cô cạn dd thu được m gam muối khan. Giá trị của m là
A. 3,01g B. 1,945g C. 2,995g D. 2,84g
Câu 23: Hoà tan hoàn toàn 19,5 gam Kali kim loại vào 381 gam nước thu được dung dịch A. Nồng độ % của chất tan trong dung dịch A là:
A. 7% B. 4,875% C. 7,35% D. 5,12%
Câu 24: Một nguyên tố R có hoá trị trong oxit cao nhất bằng hoá trị trong hợp chất khí với hiđro. Phân tử khối của oxit này bằng 1,875 lần phân tử khối của hợp chất khí với hiđro. N guyên tố R là
A. N B. C C. Si D. S
II. Tự luận: (4 điểm)
Câu 1: (2đ) Xác định chất khử, chất oxi hóa, và cân bằng phương trình phản ứng theo phương pháp cân bằng electron:
a. K2MnO4 + FeSO4 + H2SO4 → MnSO4 + Fe2(SO4)3 + K2SO4 + H2O
b. MnO2 + HCl → MnCl2 + Cl2 + H2O
Câu 2: (2đ) Hòa tan hoàn toàn 6,4 gam hỗn hợp gồm hai kim loại A, B thuộc nhóm IIA và thuộc hai chu kỳ liên tiếp nhau trong bảng tuần hoàn vào dung dịch HCl vừa đủ thu được 4,48 lít khí H2 (đktc).
Xác định hai kim loại A, B.
Tính khối lượng mỗi kim loại trong hỗn hợp.
(Cho Be =9, Mg =24, Ca =40, Sr =88)











