Đề khảo sát HSG Hóa 9 huyện Tiến Hải năm 2017-2018
Nội dung tài liệu
Tải xuốngCác tài liệu liên quan
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 8]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 11]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 7]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 6]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 5]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 4]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 3]()
-
![Đề thi học kì 1 Hóa 9 ĐỀ SỐ 2]()
-
![Đề thi thử tốt nghiệp THPTQG môn Ngữ Văn đề số 9 năm 2021]()
-
![Đề thi học kì 2 Hóa 9 trường THCS Lê Hồng Phong năm 2021-2022]()
Có thể bạn quan tâm
Thông tin tài liệu
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO TIỀN HẢI |
ĐỀ KHẢO SÁT HỌC SINH GIỎI NĂM HỌC 2017–2018 MÔN: HÓA HỌC 9 (Thời gian làm bài 120 phút) |
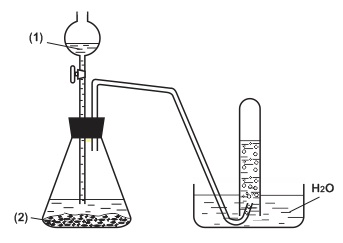 Câu 1: (3,0 điểm )
Câu 1: (3,0 điểm )
1. Hình vẽ bên mô tả thí nghiệm điều chế khí H2 trong phòng thí nghiệm, hãy cho biết:
- Hóa chất cần dùng ở (1) và (2) là gì?
- Viết phương trình hóa học minh họa.
- Khí H2 đã thu được bằng phương pháp gì? Phương pháp này dựa trên tính chất nào của H2?
2. Viết phương trình hóa học thực hiện chuyển hóa sau:
NaOH → NaCl → NaOH → NaHCO3 → Na2CO3 → Na2SO4
Na2O NaNO3
Câu 2: (3,0 điểm)
1. Ở 1000C độ tan của NaNO3 là 180 gam và ở 200C là 88 gam. Hỏi có bao nhiêu gam NaNO3 kết tinh trở lại khi làm nguội 672 gam dung dịch NaNO3 bão hòa từ 1000C xuống 200C?
2. Từ dung dịch H2SO4 98% (khối lượng riêng 1,84 g/ml), dung dịch HCl 5M, nước cất và các dụng cụ cần thiết khác, hãy trình bày cách pha chế 300 ml dung dịch chứa hỗn hợp H2SO4 1M và HCl 1M.
Câu 3: (3,0 điểm)
1. Để khử hoàn toàn 4,64 gam một oxit sắt cần dùng V lít khí H2 (đktc), biết sau phản ứng thu được 3,36 gam sắt. Tìm V và xác định công thức của oxit sắt.
2. Viết phương trình hóa học xảy ra trong các trường hợp sau:
a. Cho Fe vào dung dịch CuCl2.
b. Cho Ba vào dung dịch Na2SO4.
3. Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch KOH 5,6%.
a. Tìm khối lượng dung dịch KOH cần dùng.
b. Tìm thể tích dung dịch KOH trên biết khối lượng riêng dung dịch KOH là 1,045 g/ml.
Câu 4: (4,0 điểm)
1. Chỉ được dùng quỳ tím hãy phân biệt các dung dịch bị mất nhãn riêng biệt sau: HCl, Ba(OH)2, Na2SO4, H2SO4 , KOH. Viết phương trình hóa học xảy ra (nếu có).
2. Có 3 lọ dung dịch HNO3, H3PO4, HCl bị mất nhãn. Chỉ dùng dung dịch AgNO3 có thể phân biệt được 3 lọ dung dịch đó không? Giải thích?
3. Hòa tan hoàn toàn hỗn hợp Na2CO3 và Na2SO4 vào nước dư, được 400 ml dung dịch A. Chia A làm hai phần bằng nhau:
Phần 1: Cho tác dụng với dung dịch HCl dư, thu được 4,48 lít khí đktc.
Phần 2: Cho tác dụng với dung dịch BaCl2 dư, thu được 86 gam kết tủa.
Tìm nồng độ mol các chất trong dung dịch A.
Câu 5: (4,0 điểm)
1. Từ quặng Pirit sắt (FeS2), O2, H2O, các chất xúc tác thích hợp. Hãy viết phương trình phản ứng điều chế muối Fe2(SO4)3.
2. Hỗn hợp X gồm Na, Ba, Na2O, BaO. Hòa tan 43,8 gam X vào nước dư, thu được 2,24 lít H2 (ở đktc) và dung dịch Y, trong đó có 41,04 gam Ba(OH)2. Hấp thụ hoàn toàn 13,44 lít CO2 (ở đktc) vào dung dịch Y thu được m gam kết tủa. Tìm m.
Câu 6: (3,0 điểm)
1. Hòa tan hỗn hợp gồm 6,4 gam CuO và 8,0 gam Fe2O3 trong 200 ml dung dịch H2SO4 1M đến khi phản ứng xảy ra hoàn toàn. Sau phản ứng thấy có m gam chất rắn không tan. Tính m.
2. Cho 8 gam hỗn hợp X chứa Mg và kim loại M vào dung dịch HCl dư, sau khi phản ứng kết thúc thu được 4,48 lít H2 (đktc). Cũng 8 gam hỗn hợp trên tan hoàn toàn trong dung dịch H2SO4 đặc nóng dư , thu được dung dịch Y và 5,6 lít SO2 duy nhất (đktc).
Viết phương trình hóa học xảy ra và xác định kim loại M.
PHÒNG GIÁO DỤC - ĐÀO TẠO TIỀN HẢI |
KỲ KHẢO SÁT SINH GIỎI NĂM HỌC 2017-2018 ĐÁP ÁN BIỂU ĐIỂM CHẤM MÔN: HÓA HỌC 9 (Đáp án và biểu điểm chấm gồm 04 trang) |
||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Câu | Ý | Nội dung | Điểm | ||||||||||||
Câu 1 (3,0đ) |
1 (1,25đ) |
- Hóa chất ở (1): dung dịch HCl, H2SO4 loãng… - Hóa chất ở (2): kim loại như Al, Fe, Mg… - pthh minh họa: Fe + 2HCl → FeCl2 + H2 ↑ - Khí H2 được thu bằng phương pháp đẩy nước Dựa trên tính chất khí H2 không tác dụng với nước, ít tan trong nước |
0,25 0,25 0,25 0,25 0,25 |
||||||||||||
2 (1,75đ) |
(1) NaOH + HCl → NaCl + H2O (2) 2NaCl + 2H2O → 2NaOH + H2 ↑ + Cl2 ↑ (3) NaOH + CO2 → NaHCO3 (4) NaHCO3 + NaOH → Na2CO3 + H2O (5) Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O (6) Na2O + H2O → 2 NaOH (7) NaOH + HNO3 → NaNO3 + H2O |
0,25 0,25 0,25 0,25 0,25 0,25 0,25 |
|||||||||||||
Câu 2 (3,0đ) |
1 (1,5đ) |
Ở 1000C: 180 gam NaNO3 tan trong 100 gam H2O tạo 280 gam dung dịch x gam NaNO3 tan trong y gam H2O tạo 672 gam dung dịch |
0,25 | ||||||||||||
| x = | 0,25 | ||||||||||||||
| y = 672- 432 = 240(g) | 0,25 | ||||||||||||||
Ở 200C: 100 gam H2O hòa tan 88 gam NaNO3 240 gam H2O hòa tan z gam NaNO3 |
0,25 | ||||||||||||||
| z = | 0,25 | ||||||||||||||
| Khối lượng NaNO3 kết tinh là: 432 – 211,2 = 220,8 (g) | 0,25 | ||||||||||||||
2 (1,5đ) |
Số mol H2SO4 0,3 mol Số mol HCl 0,3 mol |
0,25 | |||||||||||||
mH2SO4 = 0,3 . 98 = 29,4 (g) mdd H2SO4 = |
0,25 | ||||||||||||||
Vdd H2SO4 = Vdd HCl 5M = |
0,25 0,25 |
||||||||||||||
Trình bày cách pha chế: - Lấy 200 ml nước cho vào cốc dung tích 500 ml - Lấy 16,3 ml dung dịch H2SO4 98% cho từ từ vào cốc trên, khuấy đều, để nguội. - Lấy 60 ml dung dịch HCl 5M, cho từ từ vào, khuấy đều - Thêm nước đến vạch 300 ml thì dừng lại khuấy đều, ta thu được 300 ml dung dịch hỗn hợp H2SO4 1M và HCl 1M. |
0,5 | ||||||||||||||
Câu 3 (3,0đ) |
1 (1,0đ) |
Gọi công thức của oxit sắt là FexOy Pthh: FexOy + y H2 |
0,25 | ||||||||||||
mO(oxit) = 4,64 – 3,36 = 1,28 (g) nO(oxit) = 1,28: 16 = 0,08 (mol) |
0,25 | ||||||||||||||
Theo pthh: nH2 = nO(oxit) = 0,08 (mol) VH2 (đktc) = 0,08. 22,4 = 1,792 (l) |
0,25 | ||||||||||||||
nFe = 0,06 (mol) x: y = nFe : nO = 0,06 : 0,08 = 3:4 Công thức của oxit sắt là: Fe3O4 |
0,25 | ||||||||||||||
2 (0,75đ) |
a. Fe + CuCl2 → FeCl2 + Cu | 0,25 | |||||||||||||
b. Ba + 2H2O → Ba(OH)2 + H2 ↑ Ba(OH)2 + Na2SO4 → 2NaOH + BaSO4 ↓ |
0,25 0,25 |
||||||||||||||
3 (1,25đ) |
H2SO4 + 2 KOH → K2SO4 + 2 H2O | 0,25 | |||||||||||||
| nH2SO4 = 0,2 (mol) → nKOH = 0,4 (mol) | 0,25 | ||||||||||||||
| mKOH = 0,4 . 56 = 22,4 (g) | 0,25 | ||||||||||||||
| mdd KOH = | 0,25 | ||||||||||||||
| Vdd KOH = 400 : 1,045 = 382,78 (ml) | 0,25 | ||||||||||||||
Câu 4 ( 4,0đ) |
1 (1,5đ) |
- Lấy một lượng nhỏ các chất cho vào ống nghiệm, đánh số thứ tự - Cho quỳ tím lần lượt vào các dung dịch trên: + dung dịch làm quỳ tím chuyển sang màu đỏ, đó là dung dịch HCl, H2SO4 (Nhóm 1) + dung dịch làm quỳ tím chuyển sang màu xanh, đó là dung dịch KOH, Ba(OH)2 (Nhóm 2) + dung dịch không làm quỳ tím chuyển màu, đó là dung dịch Na2SO4 |
0,5 | ||||||||||||
- Dùng dung dịch Na2SO4 vừa nhận biết ở trên, cho lần lượt vào các dung dịch nhóm 2: + Dung dịch nào xuất hiện kết tủa trắng, đó là dung dịch Ba(OH)2 + dung dịch nào không có hiện tượng gì đó là dung dịch KOH Ba(OH)2 + Na2SO4 → BaSO4 ↓ + 2 NaOH |
0,25 0,25 |
||||||||||||||
- Dùng dung dịch Ba(OH)2 vừa nhận biết ở trên cho vào các dung dịch nhóm 1: + dung dịch nào xuất hiện kết tủa trắng, đó là dung dịch H2SO4 + dung dịch không có hiện tượng gì đó là dung dịch HCl Ba(OH)2 + H2SO4 → BaSO4 ↓ + 2H2O; Ba(OH)2 + 2HCl → BaCl2 + 2H2O; |
0,25 0,25 |
||||||||||||||
2 (0,5đ) |
Không thể phân biệt được vì chỉ có dung dịch HCl phản ứng được với dung dịch AgNO3 tạo kết tủa. Dung dịch HNO3 và H3PO4 đều không phản ứng được với dung dịch AgNO3 | 0,25 | |||||||||||||
| AgNO3 + HCl → AgCl ↓ + HNO3 | 0,25 | ||||||||||||||
3 ( 2,0đ) |
Phần 1: Na2CO3 + 2HCl → 2 NaCl + CO2 ↑ + H2O (1) 0,2 0,2 (mol) |
0,25 | |||||||||||||
Phần 2: Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl (2) 0,2 0,2 (mol) |
0,25 | ||||||||||||||
Na2SO4 + BaCl2 → BaSO4 ↓ + 2NaCl (3) 0,2 0,2 (mol) |
0,25 | ||||||||||||||
| nCO2 = 0,2 mol → nNa2CO3 (1) = nNa2CO3 (2) = 0,2 (mol) | 0,25 | ||||||||||||||
| mBaCO3 (2) = 0,2. 197 = 39,4 (g) | 0,25 | ||||||||||||||
| mBaSO4 (3) = 86 – 39,4 = 46,6 (g) | 0,25 | ||||||||||||||
| nBaSO4 (3) = 0,2 (mol) | 0,25 | ||||||||||||||
| CM dd Na2CO3= CM dd Na2SO4= 0,4 : 0,4 = 1M | 0,25 | ||||||||||||||
Câu 5 (4,0đ) |
1 (1,0đ) |
4 FeS2 + 11 O2  2 Fe2O3 + 8 SO2 ↑ 2 Fe2O3 + 8 SO2 ↑ |
0,25 | ||||||||||||
2SO2 + O2  2 SO3 2 SO3 |
0,25 | ||||||||||||||
| SO3 + H2O → H2SO4 | 0,25 | ||||||||||||||
| Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O | 0,25 | ||||||||||||||
2 (3,0đ) |
Gọi số mol của Na, Ba, Na2O, BaO lần lượt là a, b, c, d (mol) 2Na + 2H2O → 2NaOH + H2 ↑ a a a/2 (mol) Ba + 2H2O → Ba(OH)2 + H2 ↑ b b b (mol) Na2O + H2O → 2 NaOH c 2c (mol) BaO + H2O → Ba(OH)2 d d (mol) |
1,0 | |||||||||||||
mhh = 23 a + 137b + 62c + 153d = 43,8 (g) (1) nH2 = a/2 + b = 0,1 (mol) a +2b = 0,2 (2) nBa(OH)2 = b +d = 0,24 (mol) (3) |
0,25 | ||||||||||||||
Từ (3) ta có: 153b+ 153d = 36,72 (4) Lấy (1)-(4) ta có 23a – 16b + 62c = 7,08 (5) Từ (2) ta có 8a + 16b = 1,6 (6) Lấy (5)+(6) ta có a+ 2c = 0,28 Vậy ∑nNaOH = 0,28(mol) , ∑nBa(OH)2 = 0,24 (mol) nCO2 = 0,6 (mol) |
0,5 | ||||||||||||||
CO2 + Ba(OH)2 → BaCO3 ↓ + H2O 0,24 0,24 0,24 (mol) CO2 + 2 NaOH → Na2CO3 + H2O 0,14 0,28 0,14 (mol) CO2 + Na2CO3 + H2O → NaHCO3 0,14 0,14 0,14 (mol) CO2 + BaCO3 + H2O → Ba(HCO3)2 0,08 0,08 (mol) |
1,0 | ||||||||||||||
n↓ = 0,24 – 0,08 = 0,16 (mol) m↓ = 0,16 . 197 = 31,52 (g) |
0,25 | ||||||||||||||
Câu 6 (3,0đ) |
1 (1,0đ) |
Số mol CuO = 6,4 : 80 = 0,08 (mol) Số mol Fe2O3 : 8: 160 = 0,05 (mol) Số mol H2SO4: 0,2. 1 = 0,2 (mol) Sau phản ứng còn chất rắn không tan, chứng tỏ axit hết, oxit dư. |
0,25 | ||||||||||||
CuO + H2SO4 → CuSO4 + H2O Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O |
0,25 0,25 |
||||||||||||||
Trường hợp 1: CuO phản ứng trước, chất rắn là Fe2O3 Số mol Fe2O3 dư: 0,01 (mol) m = 0,01 . 160 = 1,6 (g) Trường hợp 2: Fe2O3 phản ứng trước, chất rắn là CuO Số mol CuO dư: 0,03 (mol) Vì hỗn hợp 2 Oxit phản ứng xảy ra đồng thời nên giá trị của m là: m = 0,03. 80 = 2,4 (g) vậy 1,6 < m < 2,4 |
0,25 | ||||||||||||||
2 (2,0đ) |
nH2 = 0,2 (mol) ; nSO2 = 0,25 (mol) Trường hợp 1: M không phản ứng với dung dịch HCl nhưng phản ứng với dung dịch H2SO4 đặc nóng. Gọi hóa trị của M khi tác dụng với dung với dung dịch H2SO4 đặc nóng là m (m N*) |
||||||||||||||
Mg + 2HCl →MgCl2 + H2 0,2 0,2 (mol) |
0,25 | ||||||||||||||
Mg + 2H2SO4đ 0,2 0,2 (mol) |
0,25 | ||||||||||||||
2M + 2m H2SO4 đ 0,1/ m 0,05 (mol) |
0,25 | ||||||||||||||
∑mkim loại = 0,2.24 + .MM = 8 (g) MM = 32m (g/mol) Vì M là kim loại nên m { 1; 2; 3} |
0,25 | ||||||||||||||
Kim loại M là Cu |
0,25 | ||||||||||||||
Trường hợp 2: M phản ứng với dung dịch HCl và với dung dịch H2SO4 đặc nóng. Gọi hóa trị của M khi tác dụng với dung dịch HCl là n (n N*) Gọi số mol của Mg và M lần lượt là a, b mol (a,b >0) |
|||||||||||||||
Mg + 2HCl →MgCl2 + H2 a a a (mol) 2M + 2nHCl → 2MCln + nH2 b bn/2 (mol) Mg + 2H2SO4đ a a (mol) 2M + 2m H2SO4 đ b bm/2 (mol) |
0,25 | ||||||||||||||
Ta có mhh = 24a + MMb = 8 (g) ∑nH2 = a + bn/2 = 0,2 (mol) → 2a + bn = 0,4 (1) ∑nSO2 = a + bm/2 = 0,25 (mol) → 2a + bm = 0,5 (2) Từ (1) và(2) ta có m > n |
0,25 | ||||||||||||||
Vì M là kim loại nên n,m { 1; 2; 3} + n=1, m=2 khi đó a = 0,15; b = 0,1 → MM = 44 (g/mol) (Loại) + n=1, m=3 khi đó a = 0,175; b = 0,05 → MM = 76 (g/mol) (Loại) + n=2, m=3 khi đó a= 0,1; b= 0,1 → MM = 56 (g/mol) (Chọn) Kim loại M là Fe Vậy kim loại M là Cu hoặc Fe |
0,25 |
*) Mọi cách giải khác đúng vẫn cho điểm tối đa theo thang điểm.
*) Tổ giám khảo bám sát biểu điểm thảo luận đáp án và thống nhất.
*) Chấm và cho điểm từng phần, điểm của toàn bài là tổng các điểm thành phần không làm tròn.











