BÀI 27. Điều chế khí oxi-Phản ứng phân hủy
Bài 27.1 Trang 37 Sách bài tập (SBT) Hóa học 8
Cho các phản ứng sau:
\((1)2NaN{O_3}\buildrel {{t^o}} \over\longrightarrow 2NaN{O_2} + {O_2} \uparrow \)
\((2)2{H_2}O\buildrel {điệnphân} \over\longrightarrow 2{H_2} + {O_2} \uparrow \)
\((3)CaO + C{O_2} \to CaC{O_3}\)
\((4)ZnS + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2ZnO + 2S{O_2} \uparrow \)
\((5){K_2}O + {H_2}O \to 2KOH\)
\((6)2HN{O_3}\buildrel {{t^o}} \over\longrightarrow 2N{O_2} + {H_2}O + {1 \over 2}{O_2} \uparrow \)
Số phản ứng thuộc loại phản ứng phân hủy là
A. 2 B. 3 C. 4 D. 5
Hướng dẫn giải
Phương án đúng là : Đáp án B
Bài 27.2 Trang 37 Sách bài tập (SBT) Hóa học 8
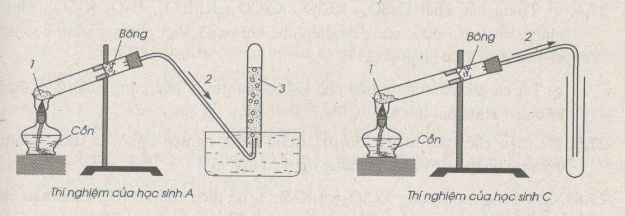
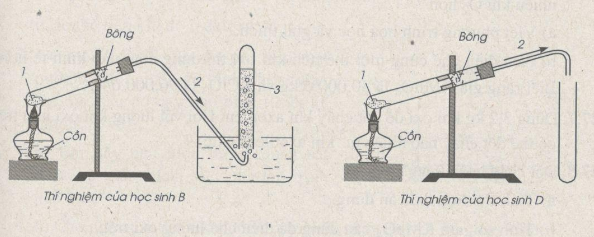
Trong bài thực hành thu khí oxi vào ống nghiệm bằng cách đẩy nước và đẩy không khí, có 4 học sinh A, B, c, D đã lắp ráp dụng cụ thí nghiệm như dưới đây. Hãy cho biết học sinh nào đã lắp ráp đúng. Lắp ráp không đúng. Giải thích. Xác định công thức các chất 1, 2, 3 có trong hình vẽ của các thí nghiệm.
Hướng dẫn giải
Chất 1 có thể là : KMnO4, KCIO3, KNO3 …, chất 2 : khí oxi; chất 3 : nước.
Học sinh A lắp ráp đúng ; học sinh B lắp ráp không đúng vì ống dẫn khí không đi vào ống nghiệm đựng nước do đó oxi bị mất một phần.
Học sinh C đã lắp ráp đúng ; học sinh D đã lắp ráp không đúng vì ống dẫn khí oxi không đi vào ống nghiệm, dẫn đến sự mất mát khí oxi.
Bài 27.3 Trang 38 Sách bài tập (SBT) Hóa học 8
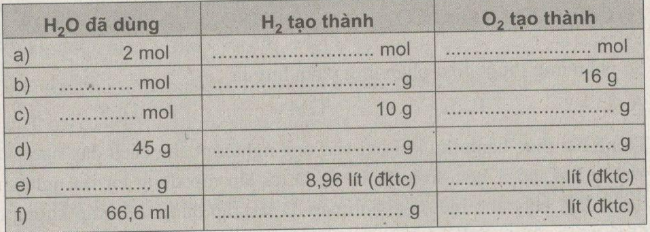
Trong công nghiệp, oxi được điều chế bằng phương pháp điện phân nước (có pha axit sunfuric), thu được 2 chất khí riêng biệt là oxi và hiđro. Phương trình điện phân nước được biểu diễn như sau :
\(2{H_2}O\buildrel {đp} \over\longrightarrow 2{H_2} + {O_2}\)
(lỏng) (khí ) (khí)
Điền những số liệu thích hợp vào những chỗ trống trong bảng dưới đây:
Hướng dẫn giải
Những số liệu thích hợp được điền vào như sau:
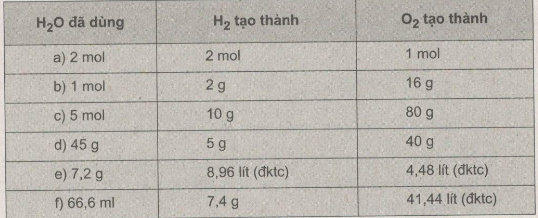
Bài 27.4 Trang 38 Sách bài tập (SBT) Hóa học 8
a) Trong các chất CuSO4, KClO3, CaCO3, KMnO4, H2O, K2SO4, HgO, những chất nào được dùng để điều chế khí oxi ? Viết phương trình hoá học I và nêu điều kiện phản ứng.
b) Tất cả các phản ứng điều chế O2 có thế gọi là phản ứng phân huỷ được không ? Hãy giải thích.
Hướng dẫn giải
a) Những chất được dùng để điều chế oxi:
\(2KCl{O_3}\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{Mn{O_2}}^{{t^o}}} 2KCl + 3{O_2} \uparrow \)
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
\(2HgO\buildrel {{t^o}} \over\longrightarrow 2Hg + {O_2} \uparrow \)
\(2{H_2}O\buildrel {dp} \over\longrightarrow 2{H_2} \uparrow + {O_2} \uparrow \)
b) Tất cả các phản ứng điều chế oxi đều là phản ứng phân huỷ vì từ một chất sinh ra nhiều chất mới (trừ cách điều chế oxi từ không khí).
Bài 27.5 Trang 38 Sách bài tập (SBT) Hóa học 8
Để điều chế một lượng lớn oxi trong công nghiệp người ta dùng những phương pháp nào và bằng những nguyên liệu gì ?
Hướng dẫn giải
Để điều chế một lượng lớn oxi trong công nghiệp người ta thường dùng phương pháp điện phân nước hoặc hoá lỏng không khí (ở -196 °C) rồi cho bay hơi trở lại, nitơ thoát ra trước rồi đến oxi. Nguồn nguyên liệu phong phú và rẻ tiền là nước và không khí.
Bài 27.6* Trang 38 Sách bài tập (SBT) Hóa học 8
Lấy cùng một lượng KClO3 và KMnO4 để điều chế khí O2. Chất nào cho nhiều khí O2 hơn ?
a) Viết phương trình hoá học và giải thích.
b) Nếu điều chế cùng một thể tích khí oxi thì dùng chất nào kinh tế hơn ? Biết rằng giá KMnO4 là 30.000 đ/kg và KClO3 là 96.000 đ/kg.
Hướng dẫn giải
a) \({M_{KCl{O_3}}} = 122,5(g/mol);{M_{KMn{O_4}}} = 158(g/mol)\)
Giả sử ta lấy cùng một khối lượng là a gam
\(2KCl{O_3}\buildrel {{t^o}} \over\longrightarrow 2KCl + 3{O_2} \uparrow \)
2 mol 3 mol
\({a \over {122,5}}mol\) \({{3a} \over {2 \times 122,5}}mol\)
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol 1 mol
\({a \over {158}}mol\) \({a \over {2 \times 158}}mol\)
\({{3a} \over {2 \times 122,5}}mol > {a \over {2 \times 158}}mol\)
Khi nhiệt phân cùng một lượng, chất cho nhiều \({O_2}\) hơn là \(KCl{O_3}\).
b) Nếu điều chế cùng một thể tích khí O2 thì dùng KClO3 để điều chế kinh tế hơn, tuy giá tiền 1 kg cao hơn nhưng thể tích khí O2 sinh ra nhiều hơn. Tính toán cụ thể như sau :
\(2KCl{O_3}\buildrel {{t^o}} \over\longrightarrow 2KCl + 3{O_2} \uparrow \)
2 mol 3 mol
1 mol 1,5 mol
\({m_{KCl{O_2}}} = 1 \times 122,5 = 122,5(g)\)
Số tiền mua 122,5 g để điều chế 1,5 mol \({O_2}\) là
0,1225 x 96000 = 11760(đ)
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol 1 mol
3 mol 1,5 mol
\({m_{KMn{O_4}}} = 3 \times 158 = 474(g)\)
Số tiền mua 474 g \(KMn{O_4}\) để điều chế 1,5 mol \({O_2}\) là:
0,474 x 30000 = 14220(đ)
Bài 27.7 Trang 38 Sách bài tập (SBT) Hóa học 8
Dùng 3,2 kg khí oxi để đốt cháy khí axetilen. Hỏi với lượng khí oxi như trên, có thể đốt cháy bao nhiêu m3 khí axetilen (đktc) ?
Hướng dẫn giải
Số mol khí oxi: \({{3,2 \times 1000} \over {32}} = 100(mol)\).
Phương trình hóa học:
\(2{C_2}{H_2} + 5{O_5} \to 4C{O_2} + 2{H_2}O\)
2 mol \( \to \) 5 mol
x mol \( \leftarrow \) 100mol
\(x = {{100 \times 2} \over 5} = 40(mol)\)
Số m3 khí axetilen bị đốt cháy: \({{44 \times 22,4} \over {1000}} = 0,896({m^3})\)
\((1{m^3} = 1000d{m^3} = 1000lít)\)
Bài 27.8 Trang 38 Sách bài tập (SBT) Hóa học 8
Đốt cháy hoàn toàn 5,4 g Al.
a) Tính thể tích oxi cần dùng.
b) Tính số gam KMnO4 cần dùng để điều chế lượng oxi trên.
Hướng dẫn giải
a) Số mol Al: \({{5,4} \over {27}} = 0,2(mol)\)
\(4Al + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
4 mol 3 mol
0,2 mol\( \to \) x mol
\(x = {{0,2 \times 3} \over 4} = 0,15(mol)\)
Thể tích khí oxi cần dùng để đốt chấy hoàn toàn 5,4 g Al là:
0,15 x 22,4 = 3,36 (lít)
b) Phương trình hóa học
\(2KMn{O_4}\buildrel {{t^o}} \over\longrightarrow {K_2}Mn{O_4} + {O_2} \uparrow + Mn{O_2}\)
2 mol \( \to \) 1 mol
y mol \(\leftarrow \) 0,15 mol
\({n_{KMn{O_4}}} = y = 0,15 \times 2 = 0,30(mol)\)
Khối lượng \(KMn{O_4}\) cần dùng để điều chế 0,15 mol oxi là:
0,30 x 158 = 47,4(g)
Bài 27.9 Trang 39 Sách bài tập (SBT) Hóa học 8
Người ta điều chế vôi sống (CaO) bằng cách nung đá vôi (CaCO3). Lượng vôi sống thu được từ 1 tấn đá vôi có chứa 10% tạp chất là
A. 0,252 tấn. B. 0,378 tấn. C. 0,504 tấn. D. 0,606 tấn.
(Biết hiệu suất phản ứng là 100%).
Hướng dẫn giải
Phương án C
Khối lượng \(CaC{O_3}\) trong 1 tấn đá vôi là \({{1 \times 90} \over {100}} = 0,9\) (tấn)
Phương trình nhiệt phân
\(CaC{O_3}\buildrel {{t^o}} \over\longrightarrow CaO + C{O_2} \uparrow \)
100 tấn \( \to \) 56 tấn
0,9 tấn \(\to \) x tấn
\(x = {{0,9 \times 56} \over {100}} = 0,504\)




