Đề thi học kì 1 Hóa 8 trường THCS Nam Tiên
Nội dung tài liệu
Tải xuống
Link tài liệu:
Các tài liệu liên quan
-
![Đề thi học kì 1 Hóa 8 trường THCS TT Vĩnh Tường năm 2017-2018]()
-
![Đề kiểm tra học kì 1 Hóa lớp 8]()
-
![Đề thi học kì 1 Hóa lớp 8 năm 2016-2017]()
-
![Đề thi học kì 1 Hóa lớp 8]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Thái Bình năm 2016-2017]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Biên Giới năm 2016-2017]()
-
![Đề thi học kì 1 Hóa 8]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Sơn Lâm năm 2021-2022]()
-
![Đề thi học kì 1 Hóa 8 năm 2020-2021]()
-
![Đề thi học kì 2 Hóa 8 trường PTDTBT THCS Liên xã La ÊÊ - Chơ Chun năm 2021-2022]()
Có thể bạn quan tâm
Thông tin tài liệu
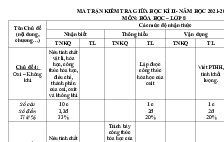
Cấp độ
Nội
dung
ChấtNguyên tửPhân tử
Số điểm
Định luật
BTKL.
Phản ứng
hóa học
Số điểm
Nhận biết
TN
C1,
C5,
C6
T
L
Thông hiểu
TN
TL
Vận dụng
VD thấp
TN
VD cao
TL
TN
C4,C7
0,75đ
0,5đ
C2
C13
C10
C17
C16
0,25đ
0,25đ
0,25đ
2đ
0,25đ
Mol và tính C3,
toán hóa học C12,
C15
Số điểm
0,75đ
T.câu
7
T. điểm
1,75đ
TL
Tổng
Điểm
C14
0,25đ
4
1đ
1,25đ
C8, C9, C11 C18
0,75đ
4
1đ
2,5đ
2
4,5đ
3đ
C19
1,5đ 5,75đ
1
1
19 câu
0,25đ 1,5đ 10đ
PHÒNG GD & ĐT PHÚ XUYÊN
THCS NAM TIẾN
Kiểm tra cuối kì I
Môn: Hóa Học 8
Mã đề: 100
Họ và tên:.……………………………… Lớp: 8…...
Điểm
Lời phê của giáo viên
I. Trắc nghiệm khách quan: (4 điểm) (0,25 đ/câu) Chọn đáp án đúng nhất điền vào ô trống:
Câu
1
Câu
2
Câu
3
Câu
4
Câu
5
Câu
6
Câu
7
Câu
8
Câu
9
Câu
10
Câu
11
Câu
12
Câu
13
Câu
14
Câu
15
Câu
16
I. Trắc nghiệm khách quan: (4 điểm) (0,25 đ/câu)
Câu 1: Dãy nguyên tố kim loại là:
A. K, Na, Mn, Al, Ca.
B. Ca, S, Cl, Al, Na.
C. Na, Mg, C, Ca, Na.
D. Al, Na, O, H, S.
Câu 2: Đốt cháy 2,8 gam Nhôm trong không khí có chứa Oxi thu được 3,8 gam Nhôm oxit. Tính khối lượng
của khí Oxi đã dùng:
A. 1 gam
B. 2 gam
C. 3 gam
D. 4 gam
Câu 3: Công thức chuyển đổi giữa lượng chất và khối lượng là:
A. m=n.M.
B. M= n/m.
C. M=n.m.
D. M.m.n = 1
Câu 4: Hòa tan muối ăn vào nước, được dung dich trong suốt. Cô cạn dung dịch, những hạt muối ăn lại xuất
hiện. Quá trình này được gọi là:
A. hiện tượng hòa tan.
C. hiện tượng vật lí.
. B. hiện tượng hóa học
D. hiện tượng bay hơi
Câu 5: Chất thuộc hợp chất hóa học là:
A. O2.
B. N2.
C. H2.
D. CO2
Câu 6: Trong các vật sau, đâu là vật thể tự nhiên?
A. Nhà ở.
B. Quần áo.
C. Cây cỏ.
D. Đồ dùng học tập.
Câu 7: Nguyên tử N có hoá trị III trong phân tử chất nào sau đây?
A. N2O5
B. NO
C. N2O3.
D. NO2
Câu 8: Trong 1 mol O2 có bao nhiêu nguyên tử?
A. 6,02.1023
B. 12,04. 1023
C. 6,04. 1023
D. 18,06. 1023
Câu 9: Cho natri(Na) tác dụng với H2O thu được xút( NaOH) và khí H2. Phương trình phản ứng nào sau đây đã
viết đúng?
A. 2Na + 2H2O
2NaOH + H2
B. 2Na + H2O
2NaOH + H2
C. Na + H2O
NaOH + H2
D. 3Na + 3H2O
3NaOH + 3H2
Câu 10: Đốt cháy quặng pirit sắt(FeS2) thu được sắt (III) oxit Fe2O3 và khí sunfuarơ SO2. Phương trình phản
ứng nào sau đây đã viết đúng?
A. 4FeS2 +11O2
2Fe2O3+8SO2
B. 2FeS2 + O2
Fe2O3 + SO2
Câu 11: Khí SO2 nặng hơn khí O2 bao nhiêu lần?
A. 1,5 lần.
B. 1,7 lần.
Câu12: Công thức tính thể tích chất khí (ở đktc):
n
A. V= 22,2
C. 4FeS2 +11 O2
D. FeS2 + O2
C. 2 lần.
Fe2O3 + 8SO2
Fe2O3 + 2SO2
D. 1,2 lần
B. V= n.24
C. V= n.M
D. V= n.22,4
Câu 13: Cho 5,6g sắt Fe tác dụng với dung dịch axit clohiđric HCl tạo ra 12,7g sắt (II) clorua FeCl2 và 0,2g
khí H2. Khối lượng HCl đã dùng là:
A. 7,3g
B. 14,2g
C. 9,2g
D. 8,4g
Câu 14: 6,4g khí sunfuarơ SO2 qui thành số mol phân tử là:
A. 0,01 mol
B. 0,1 mol
Câu 15: Khối lượng của 0,5 mol CO2 là:
A. 22g
B. 28g
C. 0,2 mol
C. 11,2g
D. 0,5 mol
D. 44g
Câu 16: Cho phương trình hóa học: 2Cu + O2
2CuO.
Tỉ lệ giữa số nguyên tử đồng : số phân tử oxi : số phân tử CuO là:
A. 1 : 2 : 2.
B. 2 : 2 : 1.
C. 2 : 1 : 2.
D. 2 : 1 : 1.
II. Tự luận (6 điểm )
Câu 17 (2đ): Lập phương trình hóa học của các phản ứng sau:
a. Fe + O2 -----> Fe3O4;
b. NaOH + FeCl3 ----> NaCl + Fe(OH)3
c. N2 + H2
NH3
d. KNO3 ---->
Câu 18 (2đ): a.Tính số mol của 5,6 (gam) Fe ;
b, Tính thể tích của 0,25 (mol) khí H2 ở đktc;
c,Tính khối lượng của 13 gam Kẽm;
d, Tính số mol của 18,06.1023 phân tử H2O
Câu 19 (2đ) : Cho kim loại magie tác dụng với dung dịch axit clohđric (HCl) người ta thu được muối magie
clorua ( MgCl2) và 44,8 lít khí hiđro H2.
Viết phương trình hóa học và tính khối lượng axit clohiđric và khối lượng Magie cần dùng cho phản ứng?
(Fe = 56; Zn = 65; H = 1; Cl =35,5; Mg = 24; C = 12; O = 16; S = 32)
Bài làm
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
PHÒNG GD & ĐT PHÚ XUYÊN
THCS NAM TIẾN
Kiểm tra cuối kì I
Môn: Hóa Học 8
Mã đề: 101
Họ và tên:.……………………………… Lớp: 8…...
Điểm
Lời phê của giáo viên
I. Trắc nghiệm khách quan: (4 điểm) (0,25 đ/câu) Chọn đáp án đúng nhất điền vào ô trống:
Câu
1
Câu
2
Câu
3
Câu
4
Câu
5
Câu
6
Câu
7
Câu
8
Câu
9
Câu
10
Câu
11
Câu
12
Câu
13
Câu
14
Câu
15
Câu
16
I. Trắc nghiệm khách quan: (4 điểm) (0,25 đ/câu)
Câu 1: Cho phương trình hóa học: 2Cu + O2
2CuO.
Tỉ lệ giữa số nguyên tử đồng : số phân tử oxi : số phân tử CuO là:
A. 1 : 2 : 2.
B. 2 : 2 : 1.
C. 2 : 1 : 2.
D. 2 : 1 : 1.
Câu 2: Dãy nguyên tố kim loại là:
A. K, Na, Mn, Al, Ca.
C. Na, Mg, C, Ca, Na.
B. Ca, S, Cl, Al, Na.
D. Al, Na, O, H, S.
Câu 3: Công thức chuyển đổi giữa lượng chất và khối lượng là:
A. m=n.M.
B. M= n/m.
C. M=n.m.
D. M.m.n = 1
Câu 4: Cho 5,6g sắt Fe tác dụng với dung dịch axit clohiđric HCl tạo ra 12,7g sắt (II) clorua FeCl2 và 0,2g khí
H2. Khối lượng HCl đã dùng là:
A. 7,3g
B. 14,2g
C. 9,2g
D. 8,4g
Câu 5: Chất thuộc hợp chất hóa học là:
A. O2.
B. N2.
C. H2.
D. CO2
Câu 6: Khí SO2 nặng hơn khí O2 bao nhiêu lần?
A. 1,5 lần.
B. 1,7 lần.
C. 2 lần.
D. 1,2 lần
Câu 7 : Trong các vật sau, đâu là vật thể tự nhiên?
A. Nhà ở.
B. Quần áo.
C. Cây cỏ.
D. Đồ dùng học tập.
Câu 8: Nguyên tử N có hoá trị III trong phân tử chất nào sau đây?
A. N2O5
B. NO
C. N2O3.
D. NO2
Câu 9: Cho natri(Na) tác dụng với H2O thu được xút( NaOH) và khí H2. Phương trình phản ứng nào sau đây đã
viết đúng?
A. 2Na + 2H2O
2NaOH + H2
B. 2Na + H2O
2NaOH + H2
C. Na + H2O
NaOH + H2
D. 3Na + 3H2O
3NaOH + 3H2
Câu 10: Đốt cháy quặng pirit sắt(FeS2) thu được sắt (III) oxit Fe2O3 và khí sunfuarơ SO2. Phương trình phản
ứng nào sau đây đã viết đúng?
A. 4FeS2 +11 O2
2Fe2O3 + 8SO2
B. 2FeS2 + O2
Fe2O3 + SO2
Câu 11: Trong 1 mol O2 có bao nhiêu nguyên tử?
A. 6,02.1023
B. 12,04. 1023
Câu12: Công thức tính thể tích chất khí (ở đktc):
n
A. V= 22,2
C. 4FeS2 +11 O2
D. FeS2 + O2
C. 6,04. 1023
Fe2O3 + 8SO2
Fe2O3 + 2SO2
D. 18,06. 1023
B. V= n.24
C. V= n.M
D. V= n.22,4
Câu 2: Đốt cháy 2,8 gam Nhôm trong không khí có chứa Oxi thu được 3,8 gam Nhôm oxit. Tính khối lượng
của khí Oxi đã dùng:
A. 1 gam
B. 2 gam
C. 3 gam
D. 4 gam
Câu 14: 6,4g khí sunfuarơ SO2 qui thành số mol phân tử là:
A. 0,01 mol
B. 0,1 mol
C. 0,2 mol
D. 0,5 mol
Câu 15: Hòa tan muối ăn vào nước, được dung dich trong suốt. Cô cạn dung dịch, những hạt muối ăn lại xuất
hiện. Quá trình này được gọi là:
A. hiện tượng hòa tan.
C. hiện tượng vật lí.
. B. hiện tượng hóa học
D. hiện tượng bay hơi
Câu 16: Khối lượng của 0,5 mol CO2 là:
A. 22g
B. 28g
C. 11,2g
D. 44g
II. Tự luận (6 điểm )
Câu 17 (2đ): Lập phương trình hóa học của các phản ứng sau:
a. Fe + O2 -----> Fe3O4;
b. NaOH + FeCl3 ----> NaCl + Fe(OH)3
c. N2 + H2
NH3
d. KNO3 ---->
Câu 18 (2đ): a.Tính số mol của 5,6 (gam) Fe ;
b, Tính thể tích của 0,25 (mol) khí H2 ở đktc;
c,Tính khối lượng của 13 gam Kẽm;
d, Tính số mol của 18,06.1023 phân tử H2O
Câu 19 (2đ) : Cho kim loại magie tác dụng với dung dịch axit clohđric (HCl) người ta thu được muối magie
clorua ( MgCl2) và 44,8 lít khí hiđro H2.
Viết phương trình hóa học và tính khối lượng axit clohiđric và khối lượng Magie cần dùng cho phản ứng?
(Fe = 56; Zn = 65; H = 1; Cl =35,5; Mg = 24; C = 12; O = 16; S = 32)
Bài làm
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
…………………………………………………………………………………………………….
ĐÁP ÁN VÀ BẢNG ĐIỂM
1. Trắc nghiệm khách quan:
Mỗi ý đúng được 0,25 điểm.
Đề 100
Câu
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Đáp án A A A D D C C A A A C D A B A C
Đề 101
Câu
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Đáp án C A A A D C C C A A A D A B D A
2. Tự luận:
Nội dung
Điểm
Câu 1:
a. 3Fe + 2O2
→ Fe3O4
0,5đ
b. 3NaOH + FeCl3 →
3NaCl + Fe(OH)3
0,5đ
0,5đ
c. N2 + 3H2
2NH3
d. 2KNO3
0,5đ
Câu 2:
a, nFe = m/M = 5,6/56 = 0,1 mol
nCO2 = m/M = 88/44 = 2 mol
nCu = N/NA = 3,0115.1023 / (6,023.1023) = 0,5 mol
nH2O = N/NA = 18,06.1023 / (6,023.1023) = 3 mol
Câu 3:
0,5đ
0,5đ
0,5đ
0,5đ
PTHH:
0,5đ
Mg + 2HCl → MgCl2 + H2
0,5đ
b. nH2 = V/22,4 = 44,8 / 22,4 = 2 mol
Từ PTHH, ta có :
0,5đ
nHCl = 2 . nH2 = 2. 2 = 4 mol => mHCl = nHCl . M = 4.36,5 = 146g
nMg = nH2 = 2 mol => mMg = nMg . M = 2.24 = 48g
0,5đ
Tổng kết điểm:
Điểm
SS
0
1
2
3
4
5
6
7
8
9
10
Lớp
8C
8D
30
29
VII. Rút kinh nghiệm:
...……………………………………………………………………………………
……………………………………………………………………………………
Nam Tiến, ngày tháng năm 2020
Phê duyệt của tổ chuyên môn
Phê duyệt của BGH
Nguyễn Hồng Tâm
Vũ Thị Phương Quế