Đề thi học kì 1 Hóa 8 trường THCS Cộng Hòa năm 2020-2021
Nội dung tài liệu
Tải xuống
Link tài liệu:
Các tài liệu liên quan
-
![Đề thi học kì 1 Hóa 8 trường THCS TT Vĩnh Tường năm 2017-2018]()
-
![Đề kiểm tra học kì 1 Hóa lớp 8]()
-
![Đề thi học kì 1 Hóa lớp 8 năm 2016-2017]()
-
![Đề thi học kì 1 Hóa lớp 8]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Thái Bình năm 2016-2017]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Biên Giới năm 2016-2017]()
-
![Đề thi học kì 1 Hóa 8]()
-
![Đề thi học kì 1 Hóa 8 trường THCS Sơn Lâm năm 2021-2022]()
-
![Đề thi học kì 1 Hóa 8 năm 2020-2021]()
-
![Đề thi học kì 2 Hóa 8 trường PTDTBT THCS Liên xã La ÊÊ - Chơ Chun năm 2021-2022]()
Có thể bạn quan tâm
Thông tin tài liệu
Tiết 36
KIỂM TRA CUỐI KÌ I – NĂM HỌC: 2020 – 2021
I. MỤC TIÊU ĐỀ KIỂM TRA
1. Kiến thức
Chủ đề 1: Chất, nguyên tử, phân tử.
Chủ đề 2: Phản ứng hóa học.
Chủ đề 3: Mol và tính toán hóa học.
2. Kĩ năng
+ Tổng hợp kiến thức.
+ Rèn luyện kĩ năng tính toán, áp dụng lý thuyết vào cuộc sống.
3. Thái độ
+ Giáo dục ý thức cẩn thận.
+ lòng yêu thích môn học, đam mê khoa học.
II. CHUẨN BỊ CỦA GV - HS.
1. GV: Đề kiểm tra theo nội dung đã ôn ở tiết ôn tập.
2. HS : Ôn tập các kiến thức theo nội dung tiết ôn tập.
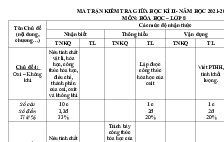
III. MA TRẬN ĐỀ
MA TRẬN ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2020 – 2021
MÔN HÓA HỌC - LỚP 8
Chương
Chủ đề
Biết Hiểu VD thấp
1
2
3
∑ câu
1. Chất (tinh khiết, hỗn hợp, tách chất, vật thể)
2. Nguyên tử (khái niệm, cấu tạo)
3. Nguyên tố hóa học (khái niệm, KHHH, NTK)
4. Đơn chất – hợp chất – phân tử (k/n, đặc điểm)
5. CTHH (ý nghĩa của CTHH, CT của đơn chất)
6. Hóa trị
1. Phân biệt hiện tượng vật lý / Hóa học
2. PƯHH (đ/n; diễn biến, khi nào xảy ra, nbiet)
3. Định luật bảo toàn khối lượng
4. Lập PTHH (cách lập + ý nghĩa)
1. Mol (đ/n, M, V?)
2. Chuyển đổi giữa m, V và n
3. Tỉ khối
4. Tính theo CTHH
5. Tính theo PTHH
TN
TN
TN
TN
TN
TN
TN
TN
TN
TN
TN
TL
TN
TN
6TN
6TN
TN
TN+TL
3TN+2TL
VD
cao
PHÒNG GD&ĐT QUỐC OAI
TRƯỜNG THCS CỘNG HÒA
ĐỀ KIỂM TRA CUỐI KÌ I [2020-2021]
TÊN MÔN HỌC: HÓA HỌC 8
Thời gian làm bài: 45 phút (15 câu TN + 2 câu TL)
Họ và tên:…………………………………………..SBD………………………Lớp…………..
(Thí sinh không được sử dụng tài liệu)
Nguyên tử khối: H = 1; C = 12; N = 14; O = 16; Na = 23; Mg = 24; Al = 27; S = 32; Cl = 35,5; K = 39;
Ca = 40; Cr = 52; Mn = 55; Fe = 56; Cu = 64; Zn = 65; Br = 80; Ag = 108; Ba = 137.
PHẦN I. TRẮC NGHIỆM (6 điểm)
Câu 1: Đâu là chất tinh khiết trong các chất dưới đây?
A. Nước cất
B. Nước mía
C. Nước dừa
D. Nước khoáng
Câu 2: Phát biểu nào dưới đây là đúng?
A. Trong mỗi nguyên tử luôn có số p = n.
B. Trong mỗi nguyên tử luôn có số p = e.
C. Trong mỗi nguyên tử luôn có số n > p.
D. Trong mỗi nguyên tử luôn có số e > p.
Bài 3: Nguyên tố hóa học là tập hợp những nguyên tử có cùng
A. số notron trong hạt nhân.
B. số proton trong hạt nhân.
C. số proton và số notron trong hạt nhân.
D. khối lượng nguyên tử.
Bài 4: Dãy gồm toàn các CTHH của đơn chất là
A. CuO, NH3, O3.
B. N2, HCl, H2SO4.
C. Mg, N2, O2.
D. HCl, H2O, Na.
Bài 5: Cách viết nào dưới đây biểu diễn 6 phân tử hidro?
A. 6H
B. 3H2
C. 2H3
D. 6H2
Bài 6: X và Y tạo được các hợp chất: XSO4 và YH3. CTHH của hợp chất tạo bởi X và Y là
A. X2Y3
B. X3Y2
C. XY
D. XY3
Câu 7: Trong các hiện tượng sau, hiện tượng nào sau đây là hiện tượng vật lý?
A. Thủy tinh nóng chảy được thổi thành chai.
B. Sắt bị gỉ chuyển thành một chất màu đỏ.
C. Về mùa hè, thức ăn bị thiu.
D. Đốt cháy than tạo ra nhiều khí độc.
Bài 8: Phản ứng hóa học là
A. Quá trình biến hợp chất thành đơn chất.
B. Quá trình biến đổi trạng thái của chất.
C. Quá trình biến đổi chất này thành chất khác.
D. Quá trình biến 1 chất thành nhiều chất.
Bài 9: Cho m gam kim loại Al tác dụng hết với 3,2 gam khí oxi thu được 16 gam Al2O3. m là
A. 10,8
B. 12,8
C. 11,8
D. 9,8
Bài 10: Cho sơ đồ phản ứng: P + O2 → P2O5. Hệ số lần lượt của P, O2, P2O5 trong PTHH là
A. 1,1,1
B. 4,5,2
C. 2,5,2
D. 2,2,5
Bài 11: Công thức tính mol nào sau đây là sai?
số nguyên tử
m
V
M
A. n=
B. n=
C. n=
D. n=
23
M
22,4
m
6,023.1 0
Bài 12: Dãy gồm các khí đều thu được vào lọ như mô tả hình vẽ là
A. NH3; CO2
B. H2; N2
C. CO2; O2
D. O2; H2
Câu 13: Cho sơ đồ phản ứng: KClO3 → KCl + O2. Để được 6,72 lít O2 (đktc) cần m (g) KClO3. m là
A. 24,5
B. 21,5
C. 22,5
D. 23,5
Câu 14: Khí A tạo bởi 2 nguyên tố C (chiếm 92,3%) và H. Biết MA = 26 g/mol. A có công thức là
A. C2H4
B. CH4
C. C2H2
D. C6H6
Câu 15: Thể tích của khí oxi ở đktc là 2,24 (lít). Khối lượng của khí oxi trên là
A. 1,6 gam
B. 3,2 gam
C. 16 gam
D. 32 gam
PHẦN II. TỰ LUẬN (4 điểm)
Câu 1. (2 điểm) Hoàn thành phản ứng hóa học sau? (Biết Cl hóa trị I)
o
a)
K + O2 t→ ?
o
b)
Al + Cl2 t→
c)
Ca + HCl → ? + H2
d)
o
Al + Fe2O3 t→ Al2O3 + Fe
AlCl3
Câu 2. (2 điểm) Hòa tan hết 12 gam Mg trong dung dịch HCl. Sau phản ứng thu được MgCl2
và V (lít) khí H2 (đo ở đktc).
a) Lập phương trình hóa học.
b) Tính V?
ĐÁP ÁN
PHẦN I. TRẮC NGHIỆM (6 điểm) – Mỗi ý đúng = 0,4 điểm
Câu 1 Câu 2 Câu 3 Câu 4 Câu 5
A
B
B
C
D
Câu 11 Câu 12 Câu 13 Câu 14 Câu 15
D
C
A
C
B
Câu 6
B
Câu 7
A
Câu 8
C
Câu 9
B
Câu 10
B
PHẦN II. TỰ LUẬN (4 điểm)
Câu 1. Hoàn thành phản ứng hóa học sau?
o
a) 4K + O2 t→ 2K2O
o
b) 2Al + 3Cl2 t→
+ Tìm được ? là K2O
+ Cân bằng đúng
2AlCl3
c) Ca + 2HCl → CaCl2 + H2
+ Tìm được ? là CaCl2
+ Cân bằng đúng
0,25 đ
0,25 đ
0,5 đ
+ Viết đúng sơ đồ pư
+ Cân bằng đúng
0,5 đ
0,5 đ
0,25 đ
o
d) 2Al + Fe2O3 t→ Al2O3 + 2Fe
Câu 2. Hòa tan hết 12 gam Mg trong dung dịch HCl. Sau
phản ứng thu được MgCl2 và V (lít) khí H2 (đo ở đktc).
a) Lập phương trình hóa học.
Mg + 2HCl MgCl2 + H2
b) nMg =
Điểm
0,25 đ
0,25 đ
0,5 đ
12
=0,5 mol
24
Theo PTHH: nH2 = 0,5 mol
VH2 = 0,5.22,4 = 11,2 lít
Thiếu đơn vị
0,25 đ
0,5 đ
-0,25 đ