Bài 1 trang 142 SGK Hóa học 10 Nâng cao
Chất NaBrO có tên là gì ?
A. Natri bromit
B. Natri bromua
C. Natri bromat
D. Natri hipobromit
Lời giải chi tiết
Chọn D.
Bài 2 trang 142 SGK Hóa học 10 Nâng cao
Chứng minh rằng brom có tính oxi hóa yếu hơn clo và mạnh hơn iot.
Lời giải chi tiết
Phương trình phản ứng chứng minh :
Brom có tính oxi hóa yếu hơn clo : \(C{l_2} + 2NaBr\,\, \to \,\,2NaCl + B{r_2}\)
Brom có tính oxi hóa mạnh hơn iot : \(B{r_2} + 2NaI\,\, \to \,\,2NaBr + {I_2}\)
Bài 3 trang 142 SGK Hóa học 10 Nâng cao
So sánh tính chất hóa học của axit bromhiđric với axit flohiđric và axit clohiđric.
Lời giải chi tiết
Giống nhau : Đều có tính chất chung của một axit (quỳ tím hóa đỏ, tác dụng với bazơ, tác dụng với muối, tác dụng với kim loại).
\(\eqalign{ & Fe + 2HCl\,\, \to \,\,FeC{l_2} + {H_2} \uparrow \cr & CuO + 2HBr\,\, \to \,\,CuB{r_2} + {H_2}O \cr & CaC{O_3} + 2HI\,\, \to \,\,Ca{I_2} + C{O_2} \uparrow + {H_2}O \cr} \)
Khác nhau : Từ HF đến HI : tính axit và tính khử tăng dần.
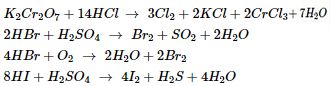
Riêng dung dịch HF ăn mòn thủy tinh : \(4HF + Si{O_2}\,\, \to \,\,Si{F_4} + 2{H_2}O\)
Bài 4 trang 142 SGK Hóa học 10 Nâng cao
Người ta có thể điều chế brom bằng cách cho axit sunfuric đặc tác dụng với hỗn hợp rắn KBr và MnO2.
a) Viết phương trình hóa học và cho biết vai trò của từng chất trong phản ứng.
b) Tính khối lượng của mỗi chất cần dùng đề điều chế 32g brom.
Lời giải chi tiết
a) Phương trình phản ứng xảy ra:

KBr là chất khử; MnO2 là chất oxi hóa, H2SO4 là môi trường.
b) Tính khối lượng mỗi chất đem dùng.
\({n_{B{r_2}}} = {{32} \over {160}} = 0,2\,\,\left( {mol} \right)\)
Theo phương trình phản ứng ta có:
\(\eqalign{ & {n_{KBr}} = 0,4\,\left( {mol} \right) \cr&\Rightarrow {m_{KBr}} = 0,4.119 = 47,6\,\left( {gam} \right) \cr & {n_{Mn{O_2}}} = 0,2\,\left( {mol} \right) \cr&\Rightarrow {m_{Mn{O_2}}} = 0,2.87 = 17,4\,\left( {gam} \right) \cr & {n_{{H_2}S{O_4}}} = 0,4\,\left( {mol} \right) \cr&\Rightarrow {m_{{H_2}S{O_4}}} = 0,4.98 = 39,2\,\left( {gam} \right) \cr} \)
Bài 5 trang 142 SGK Hóa học 10 Nâng cao
Nước biển chứa một lượng nhỏ muối natri bromua. Bằng cách làm bay hơi nước biển, người ta thu được dung dịch chứa NaBr với hàm lượng 40g/l.
Cần dùng bao nhiêu lít dung dịch đó và bao nhiêu lít khí clo (ở điều kiện tiêu chuẩn) để điều chế 3 lít brom lỏng (khối lượng riêng 3,12 kg/l ).
Lời giải chi tiết
Ta có : \({m_{B{r_2}}} = 3,12.3 = 9,36\,\left( {kg} \right)\)
\(\Rightarrow {n_{B{r_2}}} = {{9,36.1000} \over {160}} = 58,5\,\,\left( {mol} \right)\)
\(\eqalign{ & 2NaBr + C{l_2}\,\, \to \,\,2NaCl + B{r_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right) \cr & 117\,\,\, \leftarrow \,\,\,58,5\,\, \leftarrow \,\,\,\,\,\,\,\,\;\;\;\;\;\;\;\;\;\;58,5 \cr} \)
Từ \(\left( 1 \right) \Rightarrow {V_{NaBr}} = {{117.103} \over {40}} = 301,3\,\,\left( {lit} \right);\)
\({V_{C{l_2}}} = 58,5.22,4 = 1310,4\,\,\left( {lit} \right)\)
Bài 6 trang 142 SGK Hóa học 10 Nâng cao
Trong việc sản xuất brom từ các bromua có trong tự nhiên, để thu được 1 tấn brom phải dùng hết 0,6 tấn clo. Hỏi việc tiêu hao clo như vậy vượt bao nhiêu phần trăm so với lượng cần dùng theo lý thuyết ?
Lời giải chi tiết
\(\eqalign{ & 2NaBr + C{l_2}\,\, \to \,\,2NaCl + B{r_2} \cr & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,71\,\text{ tấn} \,\, \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;\;\;160\,\text{ tấn} \cr & \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,x\,?\,\,\,\,\, \;\;\;\leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;\;1\,\text{ tấn} \cr} \)
Khối lượng Cl2 dùng để sản xuất 1 tấn brom trên lý thuyết
\(x = \frac{{1.71}}{{160}} = 0,44375\) tấn
\( \to {m_{C{l_2}}}\)tiêu hao = 0,6 – 0,44375 = 0,15625 (tấn)
Khối lượng Cl2 tiêu hao thực tế vượt so với khối lượng cần dùng theo lý thuyết : \({{0,15625} \over {0,44375}}.100\% = 35,21\% \)
Bài 7 trang 142 SGK Hóa học 10 Nâng cao
Chất A là muối canxi halogenua. Cho dung dịch chứa 0,200 g A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0,376 g kết tủa bạc halogenua. Hãy xác định công thức chất A.
Lời giải chi tiết
Đặt công thức của A là CaX2 (a mol), khối lượng mol nguyên tử của X là X.
\(\eqalign{ & Ca{X_2} + 2AgN{O_3}\,\, \to \,\,Ca{\left( {N{O_3}} \right)_2} + 2AgX \downarrow \cr & \,\,\,a\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \;\;\;\;\;\;\,\to\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;2a \cr} \)
Theo đề bài : \(\left\{ \matrix{ \left( {40 + 2X} \right)a = 0,2 \hfill \cr \left( {108 + X} \right)2a = 0,376 \hfill \cr} \right. \Rightarrow X = 80\)
Vậy X là Br (brom). Công thức của A là CaBr2.
Được cập nhật: hôm kia lúc 12:59:57 | Lượt xem: 692




