Bài 1 trang 95 SGK Hóa học 10 Nâng cao
Viết phương trình biểu diễn sự hình thành các ion sau đây từ các nguyên tử tương ứng:
\(\eqalign{& {\rm{a)}}\,\,{\rm{Na}}\,\, \to \,\,{\rm{N}}{{\rm{a}}^ + }\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d)\,\,Cl\,\, \to \,\,C{l^ - } \cr& b)\,\,Mg\,\, \to \,\,M{g^{2 + }}\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,e)\,\,S\,\, \to {S^{2 - }} \cr& c)\,\,Al\,\, \to \,\,A{l^{3 + }}\,\,\,\,\,\,\,\,\,\,;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,f)\,\,O\,\, \to {O^{2 - }} \cr} \)
Lời giải chi tiết
\(\eqalign{ & {\rm{a)}}\,\,{\rm{Na}}\,\, \to \,\,{\rm{N}}{{\rm{a}}^ + } + 1e;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,d)\,\,Cl + 1e\,\, \to \,\,C{l^ - } \cr & b)\,\,Mg\,\, \to \,\,M{g^{2 + }} + 2e;\,\,\,\,\,\,\,\,\,\,\,e)\,\,S + 2e\,\, \to {S^{2 - }} \cr & c)\,\,Al\,\, \to \,\,A{l^{3 + }} + 3e;\,\,\,\,\,\,\,\,\,\,\,\,\,\,f)\,\,O + 2e\,\, \to {O^{2 - }} \cr} \)
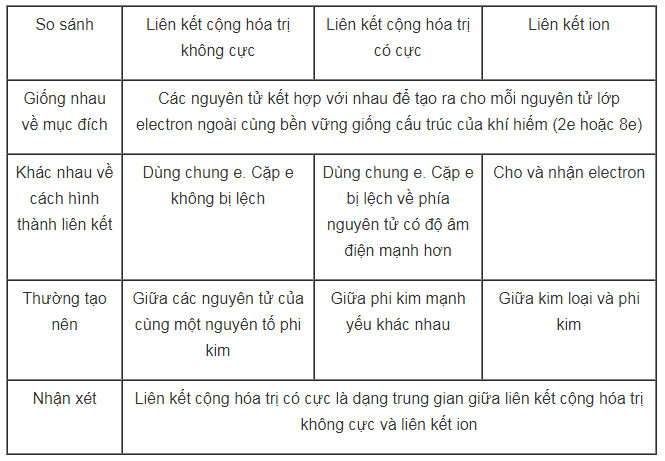
Bài 2 trang 95 SGK Hóa học 10 Nâng cao
Trình bày sự giống nhau và khác nhau giữa 3 loại liên kết sau:
a) Liên kết ion ;
b) Liên kết cộng hóa trị không cực ;
c) Liên kết cộng hóa trị có cực.
Lời giải chi tiết
Bài 3 trang 95 SGK Hóa học 10 Nâng cao
Cho dãy oxit sau: \(N{a_2}O,MgO,A{l_2}{O_3},Si{O_2},{P_2}{O_5},S{O_3},C{l_2}{O_7}.\) Dựa vào giá trị hiệu độ âm điện của 2 nguyên tử trong phân tử, hãy xác định kiểu liên kết trong từng phân tử oxit (dựa vào số liệu ở bảng 2.3)
Lời giải chi tiết
\(\eqalign{ & N{a_2}O\,\,\,MgO\,\,\,A{l_2}{O_3} \cr & \underbrace {2,51\,\,\,\,\,\,\,2,13\,\,\,\,\,\,1,83}_\text{Liên kết ion} \cr} \) \(\eqalign{ & Si{O_2}\,\,\,\,{P_2}{O_5}\,\,\,\,S{O_3} \cr & \underbrace {1,54\,\,\,\,\,\,1,25\,\,\,\,\,0,86}_\text{liên kết cộng hoá trị có cực} \cr} \) \(\eqalign{ & \,\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;\,C{l_2}{O_7} \cr & \underbrace {0,28}_\text{liên kết cộng hoá trị không cực} \cr} \)
Bài 4 trang 96 SGK Hóa học 10 Nâng cao
a) Dựa vào độ âm điện, hãy xét xem tính phi kim thay đổi như thế nào trong dãy nguyên tố sau:
O Cl S H
b) Viết công thức cấu tạo của các phân tử sau; \(C{l_2}O,NC{l_3},{H_2}S,N{H_3}\).
Xét xem phân tử nào có liên kết phân cực mạnh nhất.
Lời giải chi tiết
a) Độ âm điện của O, Cl, S, H lần lượt là: 3,44 ; 3,16 ; 2,58 ; 2,2.
Nhận xét: Tính phi kim giảm dần (O > Cl > S > H).
b) Công thức cấu tạo:
Cl – O – Cl ;

H – S – H

Hiệu độ âm điện \(\eqalign{ & C{l_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,NC{l_3}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{H_2}S\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,N{H_3} \cr & 0,28\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,12\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,38\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,84 \cr} \)
Phân tử \(C{l_2}O,NC{l_3},{H_2}S\) có liên kết cộng hóa trị không phân cực. Phân tử \(N{H_3}\) có liên kết cộng hóa trị phân cực mạnh nhất.
Bài 5 trang 96 SGK Hóa học 10 Nâng cao
Nguyên tử của một nguyên tố có cấu hình electron \(1{s^2}2{s^2}2{p^3}\)
a) Xác định vị trí của nguyên tố đó trong bảng tuần hoàn, suy ra công thức của hợp chất đơn giản nhất với hiđro.
b) Viết công thức electron và công thức cấu tạo phân tử đơn chất của nguyên tố đó.
Lời giải chi tiết
a) Vị trí của nguyên tố đó trong bảng tuần hoàn
- Tổng số electron là 7, suy ra nguyên tố ở ô thứ 7 trong bảng tuần hoàn.
- Có 2 lớp electron, suy ra nguyên tố thuộc chu kì 2.
- Thuộc nhóm VA vì có 5 electron ở lớp ngoài cùng, đó là nitơ (N).
- Công thức phân tử của hợp chất khí với hiđro là \(N{H_3}\).
b) Công thức electron

Công thức cấu tạo

Bài 6 trang 96 SGK Hóa học 10 Nâng cao
Có bao nhiêu electron trong mỗi ion sau đây: \(NO_3^ - ,SO_4^{2 - },CO_3^{2 - },B{r^ - },NH_4^ + .\)
Lời giải chi tiết
Trong \(NO_3^ - \): 7 + 3.8 + 1 = 32 electron
Trong \(SO_4^{2 - }\): 16 + 4.8 + 2 = 50 electron
Trong \(CO_3^{2 - }\): 6 + 3.8 + 2 = 32 electron
Trong \(B{r^ - }\) : 35 + 1 = 36 electron
Trong \(NH_4^ + \): 7 + 4.1 – 1 = 10 electron
Bài 7 trang 96 SGK Hóa học 10 Nâng cao
Tổng số proton trong hai ion \(XA_3^{2 - }\) và \(XA_4^{2 - }\) lần lượt là 40 và 48. Xác định các nguyên tố X, A và các ion \(XA_3^{2 - },XA_4^{2 - }.\)
Lời giải chi tiết
Trong nguyên tử A có số p = số e = \({Z_A}\), trong nguyên tử B có số p = số e = \({Z_A}\).
Theo đề bài, ta có: \(\left\{ \matrix{ {Z_X} + 3{Z_A} = 40 \hfill \cr {Z_X} + 4{Z_A} = 48 \hfill \cr} \right. \Rightarrow \left\{ \matrix{ {Z_A} = 8 \hfill \cr {Z_X} = 16 \hfill \cr} \right.\)
Vậy nguyên tố X là S và nguyên tố A là O. Các ion đã cho là \(SO_3^{2 - }\) và \(SO_4^{2 - }\).
Bài 8 trang 96 SGK Hóa học 10 Nâng cao
Xác định điện hóa trị của các nguyên tử và nhóm nguyên tử trong những hợp chất ion sau: \(BaO,{K_2}O,CaC{l_2},Al{F_3},Ca{\left( {N{O_3}} \right)_2}.\)
Lời giải chi tiết
Điện hóa trị của các nguyên tử và nhóm nguyên tử là:
\(Ba=2 + ,\,\,O = 2 - ,\,\,K = 1 + ,\,\,Ca = 2 + ,\,\,Cl = 1 -\)
\(Al = 3 + ,\,\,F = 1 - ,\,\,N{O_3} = 1-.\)
Bài 9 trang 96 SGK Hóa học 10 Nâng cao
Xác định cộng hóa trị của nguyên tử những nguyên tố trong những hợp chất cộng hóa trị sau: \(N{H_3},HBr,AlB{r_3},P{H_3},C{O_2}.\)
Lời giải chi tiết
Cộng hóa trị của các nguyên tố là:
\(N{H_3}\): N có cộng hóa trị là 3 và H có cộng hóa trị là 1
HBr: H có cộng hóa trị là 1 và Br có cộng hóa trị là 1.
\(AlB{r_3}:\) Al có cộng hóa trị là 3 và Br có cộng hóa trị là 1.
\(P{H_3}\): P có cộng hóa trị là 3 và H có cộng hóa trị là 1.
\(C{O_2}\): C có cộng hóa trị là 4 và O có cộng hóa trị là 2.
Được cập nhật: 23 tháng 4 lúc 6:09:39 | Lượt xem: 480




